

通常来说,生物过程 会被认为是由 固定的路径 控制的,其中 特定的元件 通过 具体的正向和负向的相互作用 相互连接。然而,这些模型可能无法有效地概括一些不完全依赖于特定的 代谢物 或 蛋白质,而是由 化学机制 驱动的细胞生物过程的调节。
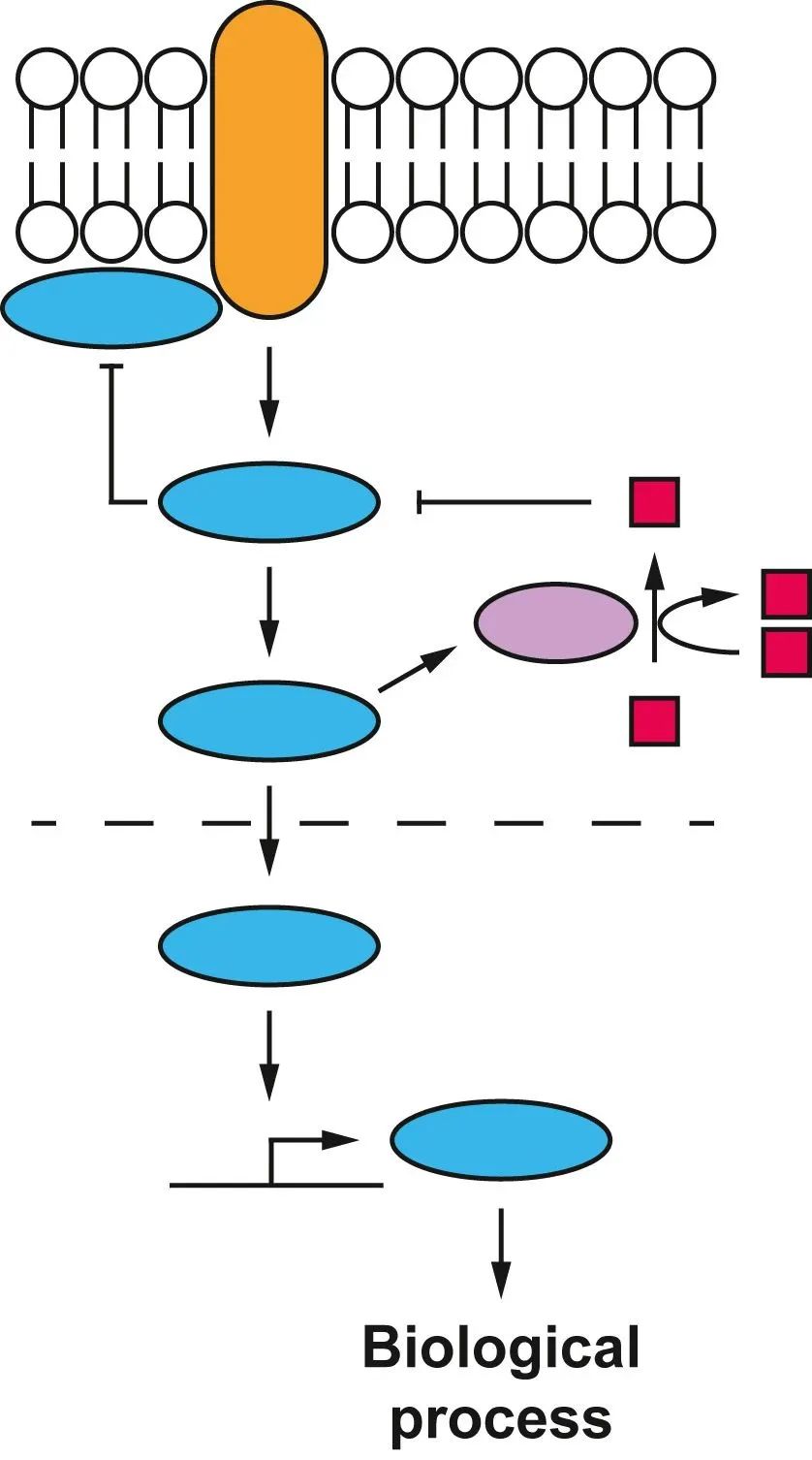
▲典型的生物过程路径图
2023 年 3 月 27 日,来自斯坦福大学的 Scott J. Dixon 和渥太华大学的 Derek A. Pratt 联合在 Molecular Cell 发表综述 Ferroptosis: A flexible constellation of related biochemical mechanisms 讨论了一种新的铁死亡模型,基于 功能相关 的代谢物和蛋白调节,不局限于特定的组织与疾病,因而具有更灵活的机制。该模型的建立对铁死亡这一细胞死亡方式的定义与研究具有重大意义,让我们一起来跟随 T 仔看看吧~

▲ 点击图片查看原文
铁死亡( ferroptosis )是近十年来才被定义并展开火热研究的一种新型细胞死亡方式,其特征是细胞内 脂质过氧化物 大量积累,超过 谷胱甘肽依赖性过氧化物酶 ( GPX4 ) 的抗氧化能力,从而破坏质膜的物理完整性,引发渗透过程,使得细胞破裂死亡。
基于这一机制,使用内源性或是合成的 亲脂性自由基捕获抗氧化剂 ( RTA ),如维生素 E 和 ferrostatin-1 可以防止脂质过氧化物积累并特异性抑制铁死亡。
十年来,大量研究表明铁死亡在体内的发生存在着多条途径。起初作者尝试以传统方式呈现铁死亡机制的关键要素(如下图所示)。但在查阅大量文献后发现这种呈现形式具有一些难以解决的缺陷。 首先,有许多不同的代谢物和蛋白质都可以启动或调节铁死亡,但都不是必须的。其次,一些代谢物和蛋白质对铁死亡敏感性的影响会随细胞类型和铁死亡诱导方式的不同而大相径庭。

▲ 铁死亡传统通路图
采用这种方式概括铁死亡的调控通路势必存在大量冗余与矛盾性,难以判断抑制或激活图中任何一种元素对铁死亡过程会造成怎样的影响。
因此,本文提出了铁死亡调节的三个原则:
(1)没有单一通用的铁死亡途径;
(2)许多不同的的代谢物和蛋白质都可以启动、促进和调节铁死亡,但都不是必须的;
(3)细胞的铁死亡敏感性可以被许多信号和转录网络改变。
并基于这三个原则,建立了一个以 铁死亡核心机制、内源性防御机制 和 铁死亡敏感性调节半影(regulatory penumbra) 三部分组成的灵活模型:
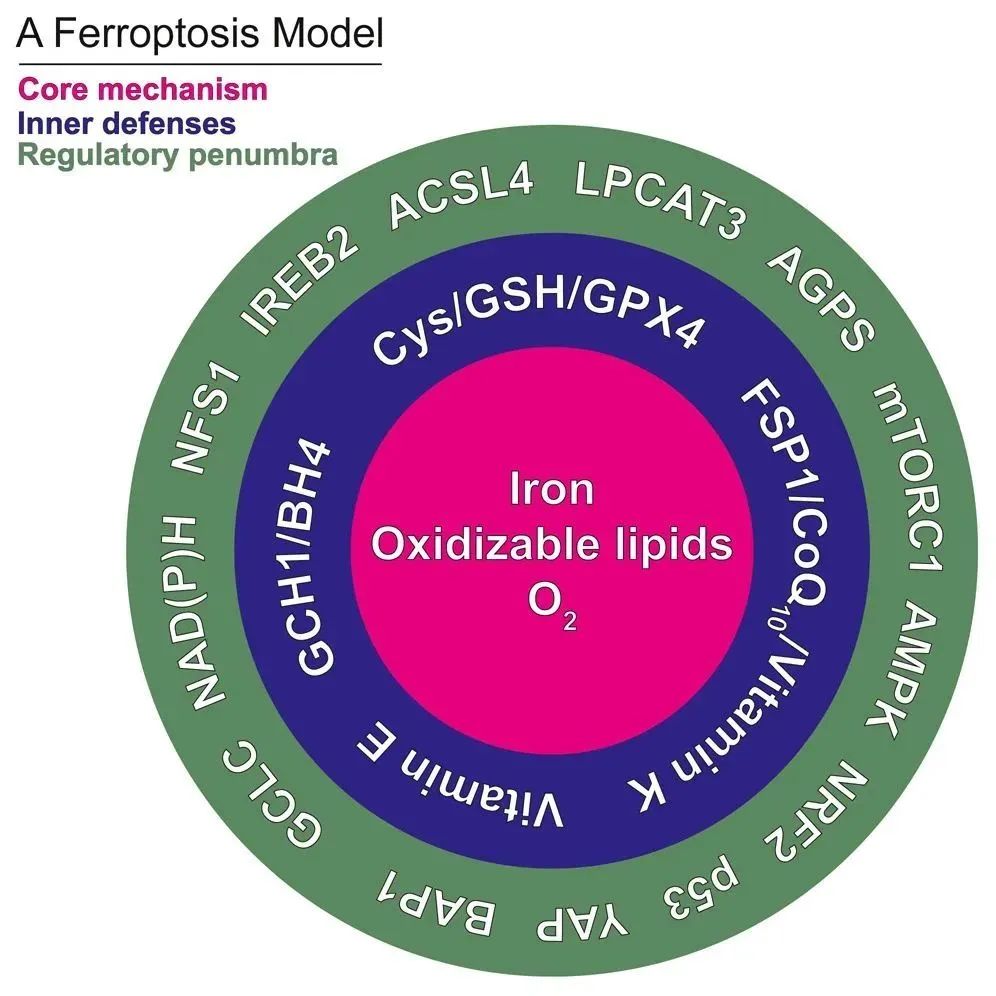
▲ 基于功能的铁死亡灵活调控模型
铁死亡核心机制

铁死亡的诱导
铁死亡的核心—— 脂质过氧化 指 分子氧( O2 )并入脂质的过程,是一种自由基介导的链式反应,可以通过多种方式启动。
过氧化氢 ( H2O2 ) 与还原铁反应(芬顿反应)形成的 羟基自由基 ( HO· ) 已被广泛认为是脂质过氧化反应的起始物质。同时,更持久的 过氧化氢自由基 ( HOO· ),即超氧化物的共轭酸 ( pKa ∼ 5 ),也可作为脂质过氧化反应的起始物质。而 O2·− /HOO· 在膜磷脂 ( phospholipids,PLs ) 附近的形成可由多种途径诱导,包括 NAD(P)H 氧化酶 ( NOX ) 、氧化还原酶( 如细胞色素 P450 氧化还原酶 [ POR ] 和细胞色素 b5 还原酶 1 [ CYB5R1 ] )和线粒体电子传递链 ( ETC ) 。
除了自发的化学反应外,脂肪氧化酶 ( LOX ) 还可以区域特异性和立体特异性催化脂质过氧化反应。LOX15 ( ALOX15, 15-LOX ) 与磷脂酰乙醇胺 ( PE ) 结合蛋白 1 ( PEBP1 ) 的复合物在某些疾病情况下会促进铁死亡。
单独破坏这些酶,或使整个线粒体 ETC 失效,对铁死亡的影响在不同的细胞和环境中具有很大差异,每种酶都可以引发铁死亡,但却都不是必要的,它们在不同的环境中会以不同形式的组合协同引发脂质过氧化。

脂质在铁死亡中的作用
多不饱和脂肪酸- PL( PUFA-PLs )的过氧化是一种铁死亡的普遍特征,并且是膜发生致死性渗透反应所必需的。
在成纤维细胞中 PUFA-磷脂酰乙醇胺( PUFA-PEs )是铁死亡过程中重要的氧化靶标,而在其他细胞中 PUFA-磷脂酰肌醇( PUFA-PIs ) 的氧化在铁死亡过程中占主导地位。在铁死亡过程中也观察到许多 PUFA-PEs、PUFA-磷脂酰胆碱 ( PUFA-PCs ) 和其他 二酰基 PLs 的丢失。PUFA 醚连接 PL(即缩醛磷脂)的氧化也能在某些系统中驱动铁死亡。
这些证据表明,多种 PUFA-PLs 都可以引发铁死亡,但却也都不是必要的。

铁在铁死亡中的作用
铁 通过在各种氧化态之间循环,提供或接受电子,从而促进电池中的各种氧化还原反应。
目前已发现至少 两种 不同的铁参与铁死亡核心机制的方式。哺乳动物细胞内含有一个与生理配体协松散调的铁池 ( ~10 μM ),即不稳定铁池 ( LIP )。在某些情况下,LIP 可促进自发性自氧化和铁死亡。同时,启动脂质过氧化反应的 NOX 和 LOX 酶也需要铁或含铁辅助因子才能发挥作用。
毋庸置疑,铁是铁死亡的核心因子,但 铁和调节铁代谢的蛋白质诱导膜脂质过氧化作用的过程却因条件而异。
铁死亡的内源性防御机制
在生物体中,有几种 维持脂质过氧化稳态 的酶和代谢物抑制铁死亡的发生。GSH 依赖性 PL 氢过氧化物酶 (GPX4)是一种关键的硒酶,可通过将有毒的脂质氢过氧化物转化为无毒的脂质醇来防止铁死亡。因此 GPX4 抑制剂(例如,RSL3 和 ML210)在大多数培养细胞中是一种有效的铁死亡诱导剂。同时,GPX4 还是一种 GSH 依赖性酶,所以通过破坏胱氨酸/谷氨酸逆向转运系统( system xc- )中负责摄取 GSH 前体胱氨酸/半胱氨酸的逆向转运蛋白也可诱导铁死亡。
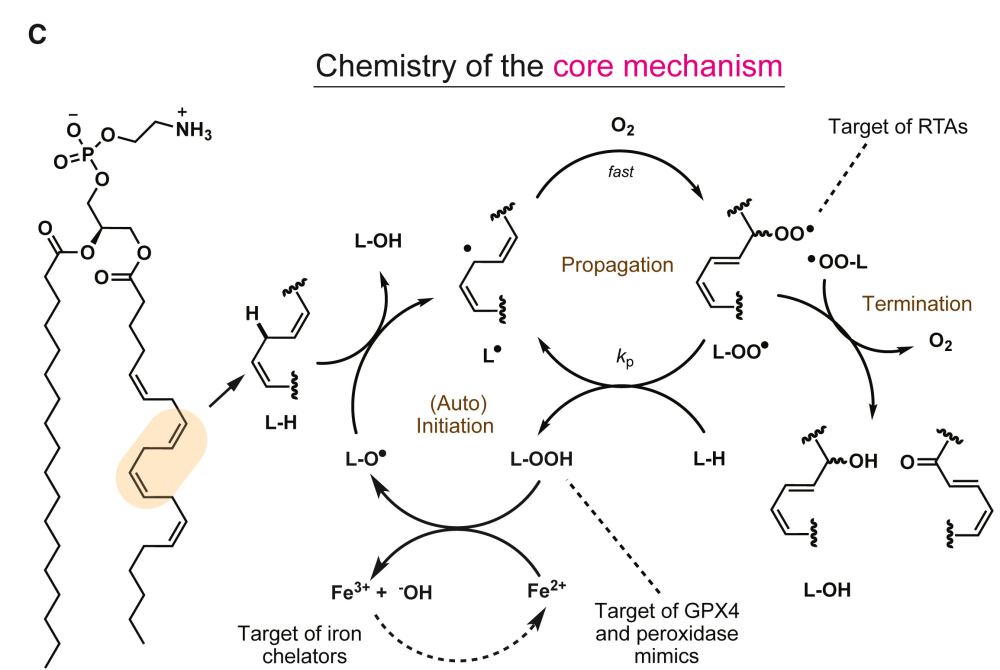
▲脂质过氧化核心机制的化学过程
还有几种非过氧化物酶的机制与 GPX4 并行运行,限制膜脂质过氧化并抑制铁死亡。这些机制通常基于内源性自由基捕获抗氧化剂 ( RTAs ) 对脂质过氧自由基传递链的拦截。该机制也具有相当大的灵活性,多种不同的 RTA 都可以抑制膜脂过氧化。如 α-生育酚(维生素 E 最活跃的形式)、铁死亡抑制蛋白 1 ( FSP1 ) 生成的还原型内源性 电子载体辅酶 Q10 ( CoQ 10 ) 和 维生素 K 、GTP 环化水解酶 I ( GCH1 ) 合成的 四氢生物蝶呤 ( BH4 ) 都具有显著的 RTA 活性,可使一些细胞对 GPX4 抑制剂具有高度抗性。这些冗余的系统平行运行,在细胞间的表达互不影响,协同起到抑制铁死亡的作用,其个体贡献因细胞和条件而异。
值得注意的是,如果 核心机制 无法产生足够的脂质过氧化物, GPX4 和其他内部防御酶的失活并不会增加脂质过氧化并引发铁死亡。只有在核心机制失控的情况下,才需要内源性防御机制来防止铁死亡。

铁死亡敏感性调节半影
铁死亡的敏感性受 调节半影 控制,这些调节机制是核心机制突破内源性防御机制引发铁死亡的主要诱因。
对核心机制或内源性防御机制中所涉及的任何 代谢物、蛋白质、通路 或 细胞器 的调节都有可能改变铁死亡敏感性。迄今为止,已报导了数百种调节机制,主要分为三大类:改变脂质或铁代谢的蛋白质、调节酶功能的信号级联反应以及控制相关蛋白质表达的转录调节因子。
其中大部分似乎在铁死亡的调节中发挥着灵活的作用,很难与通用的铁死亡机制相吻合。并且这些代谢物和蛋白质对铁死亡敏感性产生的调控在不同的铁死亡的触发方式、细胞的类型或是其他情况下会受到极大的影响。

NAD(P)H
NAD(P)H 在 消耗内源性 RTA 以及再生 GSH 中起到关键的作用。通常而言,NAD(P)H 的丰度 与铁死亡抗性相关。然而,NAD(P)H 还向 NOX 和 POR 酶提供电子,从而促进脂质过氧化反应的启动。此外, NAD(P)H 还参与长链多不饱和脂肪酸的合成。因此,NAD(P)H 可能 既限制又促进铁死亡,哪种效应占主导地位取决于不同的细胞种类。
NAD(P)H 可通过 氧化戊糖磷酸途径 ( oxPPP )、苹果酸酶 1 ( ME1 ) 和异柠檬酸脱氢酶 1 ( IDH1 ) 合成,每个途径对总 NAD(P)H 合成的相对贡献因细胞而异。因此,这三种途径以细胞类特异性的方式共同参与了铁死亡的调节半影。
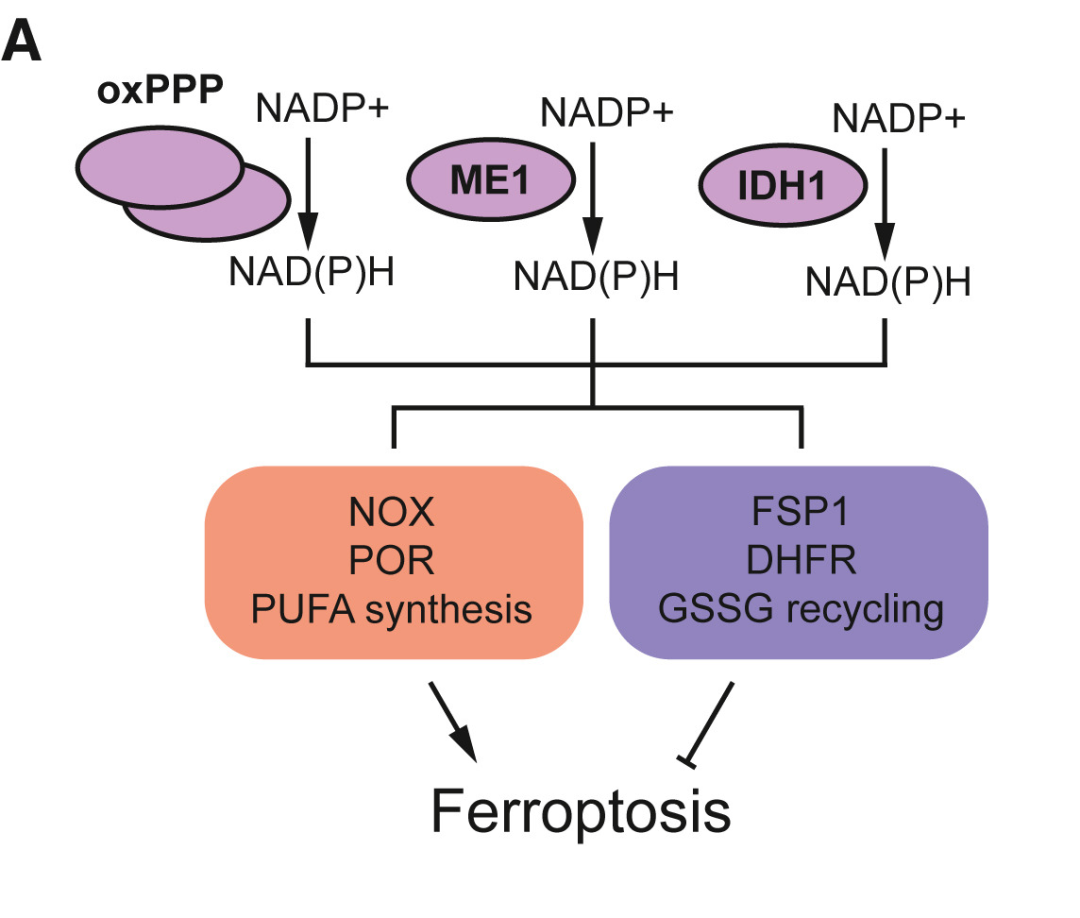
▲几种不同的酶和途径可以冗余地促进还原剂 NAD(P)H 的合成,NAD(P)H 可以同时被促进和抑制铁死亡的酶所使用

mTORC1 通路
雷帕霉素复合物 I ( mTORC1 ) 通路也可以不同方式影响铁死亡敏感性。在胱氨酸剥夺的纤维肉瘤细胞中,mTORC1通过转移半胱氨酸,限制 GSH 合成 促进铁死亡。因此, mTORC1 抑制剂对铁死亡具有抑制作用。但在肾癌细胞中,mTORC1 会通过促进 GPX4 蛋白表达抑制铁死亡;在其他细胞类型中,mTORC1 通过促进抗铁死亡 MUFA 脂质的合成来 抑制铁死亡。这三种 mTORC1 依赖性的铁死亡调节机制截然不同且相互矛盾。不同细胞与环境下这三种调节机制优先程度的差异,导致了 mTORC1 对铁死亡的作用普遍并不明显。
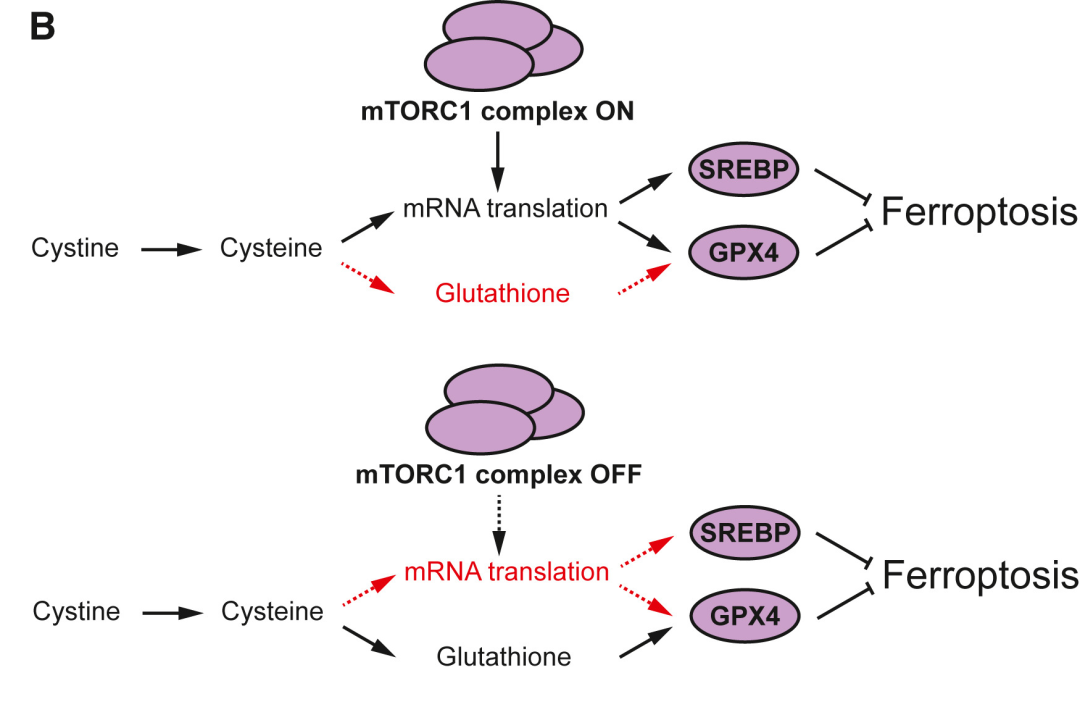
▲mTORC1 通过影响谷胱甘肽过氧化物酶 4 ( GPX4 ) 或甾醇反应元件结合蛋白 1 ( SREBP1 ) 的表达,或通过将半胱氨酸通量转移到蛋白质合成中来正向和负向调节铁死亡,与 GSH 的合成竞争。

p53通路
在一些癌细胞中,肿瘤抑制因子 p53 可以通过抑制 SLC7A11 诱导由叔丁基氢过氧化物引起的铁死亡敏感。但在其他癌细胞中, p53 的表达可以通过与蛋白酶二肽基肽酶 4 ( DPP4 ) 的相互作用或通过诱导 CDKN1A ( p21 ) 的转录来抑制铁死亡,进而抑制 GSH 依赖性核苷酸合成。因此,在不同的铁死亡启动机制下,p53 似乎可以通过不同的机制增强或抑制铁死亡。并且在其他细胞中,p53 的表达对铁死亡敏感性几乎没有影响。
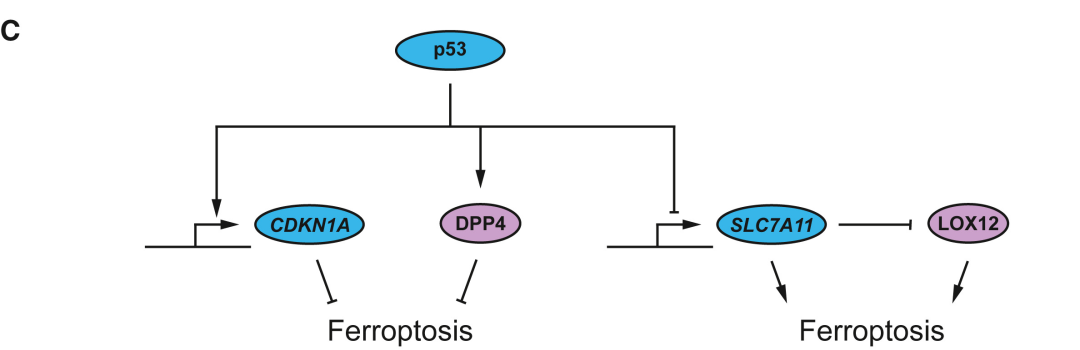
▲p53 转录因子可以通过诱导 CDKN1A 的转录或与 DPP4 的相互作用来抑制铁死亡,还可通过 SLC7A11 的转录抑制诱导铁死亡

总结
上述结果表明,铁死亡具有相当大的灵活性,很难被单一的通路与机制所概括。因此本文提出了一种灵活模型,涵盖机制可变的参与铁死亡过程的核心分子。基于这个模型,作者将影响“总脂质过氧化敏感性”和“总内源性防御能力”的因素,总结成两个公式化的铁死亡易感性定量模型:
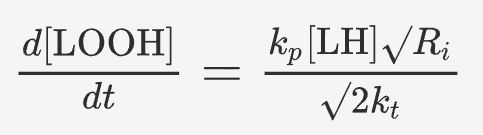
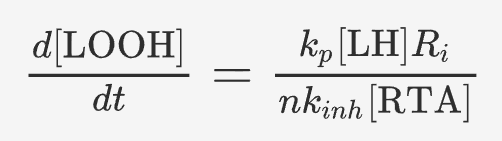
▲铁死亡易感性定量模型。[LH]:脂质浓度,kp:过氧自由基,Ri:起始速率,n和kinh:每个 RTA 的自由基捕获化学计量和反应性。
使用化学速率方程定量表示不同分子对脂质过氧化速率增强或抑制的贡献,体现总脂质过氧化敏感性和总内源性防御能力。
总脂质过氧化敏感性可能取决于 LIP 的大小、NOX、LOX、POR 和线粒体酶的表达、定位和活性;O2 含量以及不同种类 PUFA-PL 的丰度等因素。总内源性防御能力与 GSH 丰度、GPX4 和 FSP1 表达和CoQ10 水平等因素有关。当细胞的总脂质过氧化敏感性大于总内源性防御能力时,细胞将迈入铁死亡的进程。
该模型使我们能以更灵活的方式整合铁死亡模型,为相关疾病的治疗提供重要的指导。


科研助力

当下,铁死亡 相关研究依旧如火如荼,TargetMol® 铁死亡化合物库 提供 800 种 铁死亡通路 相关的化合物,可助力您靶向 GPX4、ROS、p53、Nrf2 等铁死亡相关靶点,是研究神经系统疾病、肿瘤(特别是乳腺癌、弥漫性大B细胞淋巴瘤)、缺血再灌注损伤、肾损伤、动脉粥样硬化、糖尿病、心脏病等疾病的有效工具。

欢迎点击下方产品跳转产品页查看,如感兴趣或有疑问可私聊 T 仔咨询噢~

好了,今天的 T 仔号文献列车即将到站。希望大家科研顺利哦,我们下次再见~
参考文献:
[1] Dixon SJ, Pratt DA. Ferroptosis: A flexible constellation of related biochemical mechanisms [published online ahead of print, 2023 Mar 22]. Mol Cell. 2023;S1097-2765(23)00162-4. doi:10.1016/j.molcel.2023.03.005

【更多往期推荐】




点击 阅读原文↙ 即可前往 TargetMol®中国 官网选购您心仪的产品










