
随着近十年来干细胞体外培养、诱导分化技术的发展,类器官研究也取得了飞跃性进展。类器官不仅为研究人体发育过程提供了不受伦理限制的平台,也为药物筛选开辟了新的途径。近期,有研究利用类器官药物筛选确定了软骨再生的潜在治疗靶点。
软骨损伤是导致疼痛和残疾的主要原因之一,尽管生物医学发展迅速,但目前的药物疗法只能提供短期的症状缓解,即使是手术,也存在感染风险和再生组织退化的不良后果。不过,科学家们已经取得了一些重要进展。
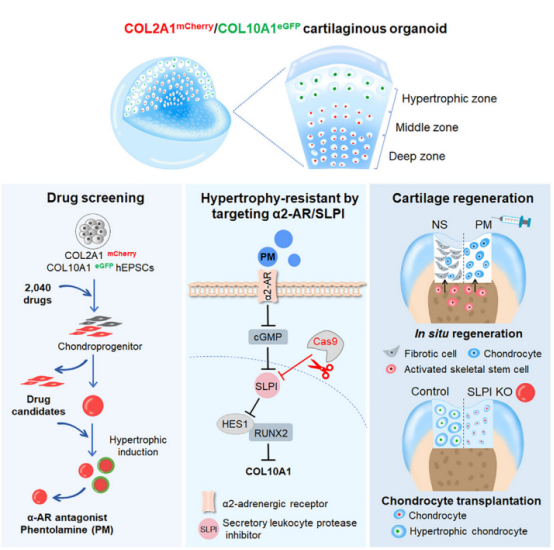
2024年9月30日,南方医科大学白晓春、高学飞研究团队在Cell Stem Cell发表了题为“A human organoid drug screen identifies α2-adrenergic receptor signaling as a therapeutic target for cartilage regeneration”的研究论文,该研究利用人类类器官药物筛选确定了α2-肾上腺素能受体信号作为软骨再生的治疗靶点。

▲机理模式图
研究构建了一种基于人扩展多能干细胞(hEPSCs)的软骨类器官系统,通过COL2A1mCherry和COL10A1eGFP双报告基因实时监控软骨发生和肥大过程。然后筛选 TargetMol上市药物库,发现 α-肾上腺素能受体(α-AR) 拮抗剂可刺激软骨形成但抑制肥大,而 α2-AR 激动剂减少软骨形成并诱导肥大。
类器官的构建
研究者通过 caspase 技术开发了一种双报告基因系统,在COL2A1和COL10A1基因位点分别插入 mCherry和 增强型绿色荧光蛋白(eGFP),从而实现对软骨生成和肥大分化的可视化。

小贴士
①. COL2A1是软骨的主要结构成分之一,主要在透明软骨中表达。它在软骨细胞的分化和成熟过程中起着关键作用,促进软骨基质的形成和维持软骨的结构完整性。在研究中,COL2A1的表达通常被用作软骨生成的标志,表明细胞正在向软骨细胞的表型转化。
②. COL10A1主要在肥大软骨中表达,通常与软骨的矿化和骨化过程相关。它在软骨发育的后期阶段起作用,尤其是在生长的肥大软骨区。COL10A1的表达标志着软骨细胞的肥大化,这是软骨发育和骨化过程中的一个重要步骤。
他们首先在二维培养系统中诱导人扩展多能干细胞(hEPSCs)分化为软骨前体,随后转入三维培养,生成软骨类器官。该类器官具有分区结构,外层为肥大区,富含COL10A1+细胞和IHH(Hedgehog信号通路的一部分,参与调控软骨生成)表达;中层为软骨生成区,含有较多COL2A1+细胞;深层富集了聚集蛋白(ACAN)和SOX9(与软骨细胞的分化相关的转录因子)。其结构模式和细胞特征与人类关节软骨类似,可用于疾病建模、药物筛选以及基因编辑和组织替代。
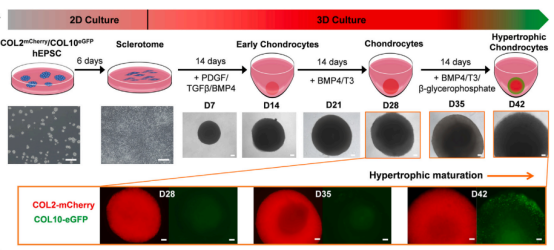
▲hEPSCs向肥大软骨类器官定向分化示意图
基于构建的类器官模型,研究者使用 TargetMol 的上市药物库进行了筛选,以寻找能够促进软骨生成并抑制肥大过程的药物。结果显示,α-肾上腺素受体(α-AR)拮抗剂——如酚妥拉明(Phentolamine,PM)、Phenoxybenzamine(PBM)、Yohimbine和Tolazoline 均能有效抑制 COL10A1 的表达。
尤其是 PM,多个浓度下显著抑制了 MMP13 和IHH的表达(抑制MMP13的活性可能有助于减缓软骨退化),并可促进 ACAN 的表达。相反,α2-AR 激动剂(如Clonidine,Guanfacine)则减少了COL2A1表达细胞的生成。
简单来说,α-AR拮抗剂具有双重功能,不仅能够促进软骨细胞分化,还能抑制肥大分化,而α2-AR激动剂则抑制软骨生成。
α2-AR信号诱导软骨细胞肥大
接下来,研究者还探索了 α2-AR 信号诱导软骨细胞肥大和软骨退化的机制。
蛋白质组学分析表明,分泌性白细胞蛋白酶抑制剂(SLPI)在软骨细胞肥大过程中显著上调,其表达与肥大标志物 COL10A1 呈正相关。进一步实验显示,SLPI在由人扩展多能干细胞(hEPSC)分化生成的软骨细胞中上调,并在人类软骨细胞暴露于IL-1β时,SLPI表达显著增加。
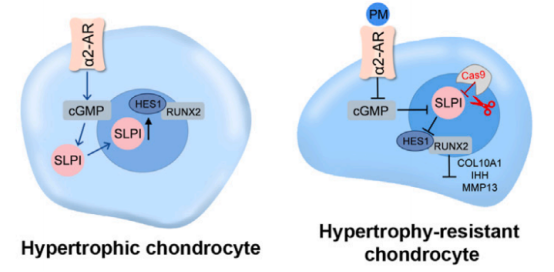
▲靶向α2-AR/SLPI以生成抗肥大的软骨细胞机制的示意图
通过SLPI基因敲除(SLPI KO),研究发现SLPI的缺失使软骨细胞对肥大分化产生抵抗作用,且肥大相关基因如IHH、RUNX2和MMP13的表达显著降低,这表明SLPI在软骨细胞肥大和退化中起到了关键作用。
进一步的推断发现,α2-AR信号通过 cGMP 依赖性途径调控 SLPI 的产生,从而影响软骨细胞的肥大与退化。使用 cGMP 类似物 8B-cGMP 可促进 SLPI 和肥大标志物 COL10A1 的表达,而 cGMP 抑制剂 MBP 则抑制这些基因的表达。
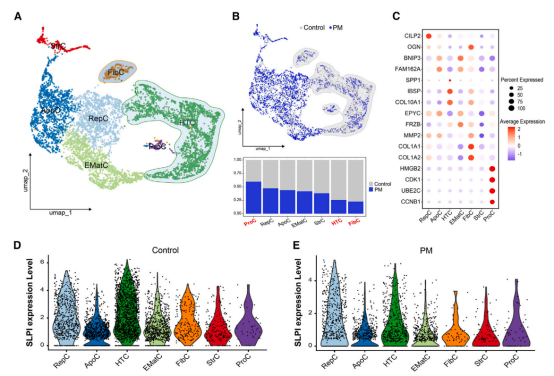
▲单细胞转录组学分析揭示通过靶向α2-AR抑制肥大和纤维化软骨细胞以及减少SLPI的产生
小结
综上,该研究利用带有双报告基因的 hEPSCs 构建了软骨类器官系统,能够实时监测软骨的生成和肥大过程。通过筛选 TargetMol 的上市药物库,研究发现 α-AR拮抗剂能够促进软骨生成并抑制肥大分化,而 α2-AR 激动剂则抑制软骨生成并诱导肥大。
从机制上看,α2-AR信号通过 cGMP 依赖性途径促进分泌性白细胞蛋白酶抑制剂(SLPI)的产生,进而诱导软骨肥大退化。缺失 SLPI 的软骨类器官对退化表现出较强的抵抗力,有助于修复大面积软骨缺损。靶向 α2-AR/SLPI 提供了一种通过促进软骨生成并抑制肥大的有前景且临床可行的软骨再生策略。
科研助力
作为一门新兴的技术,类器官在许多领域都有着巨大的应用潜力,包括 发育生物学、疾病建模、精准医学、再生医学、毒理学、药物发现研究、宿主-微生物组相互作用、基因编辑、多组学和系统发育研究 。
除了研究中所用到的 TargetMol上市药物库 外,T 仔在这还为您推荐:
TargetMol® 干细胞分化化合物库,包含3,186种干细胞分化信号通路相关的生物活性小分子化合物,囊括 Wnt、 GSK-3、Hedgehog、JAK、ROCK、γ-secretase 等多个靶点,为您的类器官培养研究添砖加瓦!
往期推荐
https://doi.org/10.1016/j.stem.2024.09.001





