
HERV-K抑制剂库

Human Endogenous Retrovirus K (HERV-K) Inhibitor Library
产品编号LF1033
人类内源性逆转录病毒K(HERV-K,其中“K”代表赖氨酸tRNA引物结合位点),亦称人畸胎瘤源性病毒(HDTV),属于人类内源性逆转录病毒(HERVs)家族。这类病毒形成于灵长类进化过程中外源性逆转录病毒的感染,约占人类基因组的8%。在HERV-K家族中,存在HML-1至HML-11(人内源性MMTV样病毒)等多个亚群,每个亚群可追溯至由不同外源性逆转录病毒引发的生殖系感染。
研究表明,HERV的再激活与肿瘤和自身免疫性疾病相关。这一现象在HERV-K(HML-2)家族中尤为显著——作为最新的整合群组,该家族突变数量最少、生物活性最强,能够编码功能性逆转录病毒蛋白并产生类逆转录病毒颗粒。虽然目前尚未发现HERV-K(HML-2)直接致病的明确证据,但其转录本异常表达模式及对邻近宿主基因的调控功能已在多种疾病中得到确认。
顺应现代药物研发趋势,我们开发了新型HERV-K筛选化合物库。该化合物库目前包含700余个类药性筛选化合物,通过基于以下药物靶点的分子对接虚拟筛选获得:
• 内源性逆转录病毒K组7号成员前体蛋白(VPK7)
产品编号LF1033
HERV-K抑制剂库规格
- 30 μL x 10 mM (in DMSO)
- 50 μL x 10 mM (in DMSO)
- 100 μL x 10 mM (in DMSO)
- 250 μL x 10 mM (in DMSO)
 产品描述
产品描述
内源性逆转录病毒K组成员7前体蛋白(VPK7)
近期研究表明,老年人内源性逆转录病毒K组成员7前体蛋白(VPK7)表达增加与脱氢表雄酮水平降低、皮质醇水平升高存在关联。这种激素比例的变化会加剧老年慢性疾病患者的炎症风险。部分VPK7表达降低的患者显示慢性疾病症状缓解,因此有必要深入探究VPK7对老年慢性病患者激素水平的影响。已知该蛋白存在于部分胎盘样本、肿瘤形成组织以及HIV感染者的脑组织中,针对该蛋白的进一步研究将具有多领域的临床价值。
化合物筛选
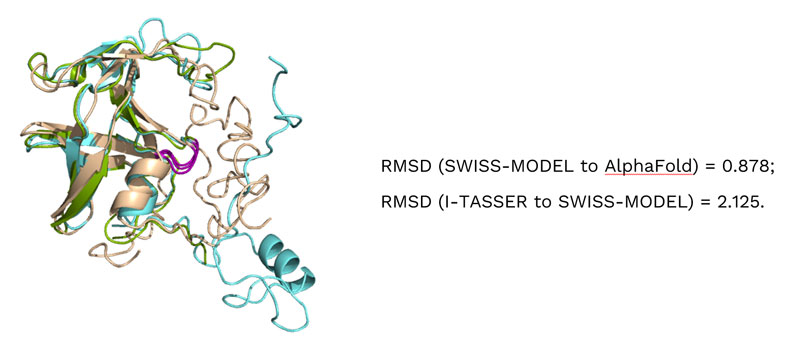
我们首先通过BLAST工具比对两条序列,识别可能反映功能与结构关联的相似区域(图1)。虽然不同同源物显示出显著相似性,但目前尚无实验确定的蛋白结构报道。因此,我们采用三种不同的计算机模型进行分子对接分析。

优先选取UniProt数据库中的AlphaFold模型,同时从SWISS-MODEL(QMEANDisCo全局评分:0.58 ± 0.06)和I-TASSER工具获取了VPK7蛋白第9-117位氨基酸残基的全原子结构。模型质量通过MolProbity进行评估:Clashscore指标显示所有原子的数值分别为AlphaFold=2.07、SWISS-MODEL=2.4、I-TASSER=13.61。Ramachandran分析表明,AlphaFold模型有94.2%的残基处于最优区域,100.0%处于允许区域;SWISS-MODEL模型有98.1%的残基处于最优区域,100.0%处于允许区域;I-TASSER模型有66.0%的残基处于最优区域,89.5%处于允许区域。
对每个模型进行了潜在活性位点预测,并确定了包含DTG催化基序的活性位点。在受体网格生成过程中,将I-TASSER和SWISS-MODEL模型的D34氨基酸残基(对应AlphaFold模型的D26位点)设定为氢键供体约束条件。
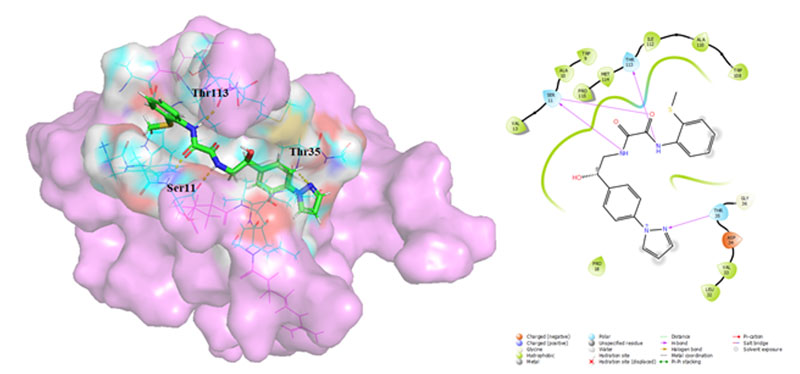
采用基于分子对接的虚拟筛选方案(薛定谔公司的Glide软件,SP模式),对内部数据库进行筛选以寻找潜在的VPK7活性位点结合剂。未设置任何对接约束条件,以便让对接算法能够探索尽可能多的配体位置与取向。
对筛选得到的化合物库进行交叉比对后,仅保留能与全部三种蛋白模型发生相互作用的化合物,并进一步应用内部MedChem过滤器及PAINS结构过滤器进行筛选。
核心参数:
• 方法:高通量虚拟筛选(分子对接)
• 使用的X射线数据:不适用
• 约束条件:DTG相互作用位点
• 应用过滤器:PAINS过滤器、毒性过滤器、反应活性过滤器
• 筛选化合物数量:700个
 包装和储存
包装和储存
- 可选用DMSO耐受的96/384孔板或2D 条形码编码管;
- 干粉蓝冰运输,DMSO溶液干冰运输;
- 排布:96孔板:1st & 12th 空白对照,384孔板:1st & 2nd & 23th & 24th空白对照。
 包装和储存
包装和储存
- 可选用DMSO耐受的96/384孔板或2D 条形码编码管;
- 干粉蓝冰运输,DMSO溶液干冰运输;
- 排布:96孔板:1st & 12th 空白对照,384孔板:1st & 2nd & 23th & 24th空白对照。
 化合物库定制
化合物库定制

 很棒
很棒